【供稿:生命科学学院】
导语:
程序性坏死作为炎症性疾病的源头调控机制,能够直接参与炎症反应的启动、放大及慢性化过程。现有坏死抑制剂虽能部分缓解炎症病理学表型,但普遍存在疗效不稳定及脱靶效应严重等问题。脱氧核酶分子凭借高度的底物特异性及高效的催化活性,能够精准靶向及沉默致病基因,为精准调控坏死性炎症提供新思路。然而,当前脱氧核酶开发手段和流程较为单一,仅依赖结构筛选及细胞学验证难以深入解析其发挥催化活性的分子机制,也无法有效指导酶分子进行定向改造。
近日,吉林大学生命科学学院李全顺/韩浩博课题组,基于程序性坏死关键靶点RIP3,搭建“理性设计-性能表征-机制解码-活性进化”的全链条脱氧核酶设计平台,获得具有高效切割活性的脱氧核酶R3-Dz。利用碱基修饰型树枝状聚合物衍生物(AP)介导R3-Dz高效转染至坏死巨噬细胞,抑制NLRP3介导坏死性炎症,对不同类型的炎症性疾病均发挥出优异的抗炎效果。该纳米复合物联合MCC950能够实现“双向阻断-标本兼治”,展现出更为优越的抗炎活性及组织修复功效(图1)。本研究不仅为靶向致病基因的脱氧核酶设计与应用提供理论指导,同时也为基于脱氧核酶构建重大疾病基因治疗策略提供新的思路。
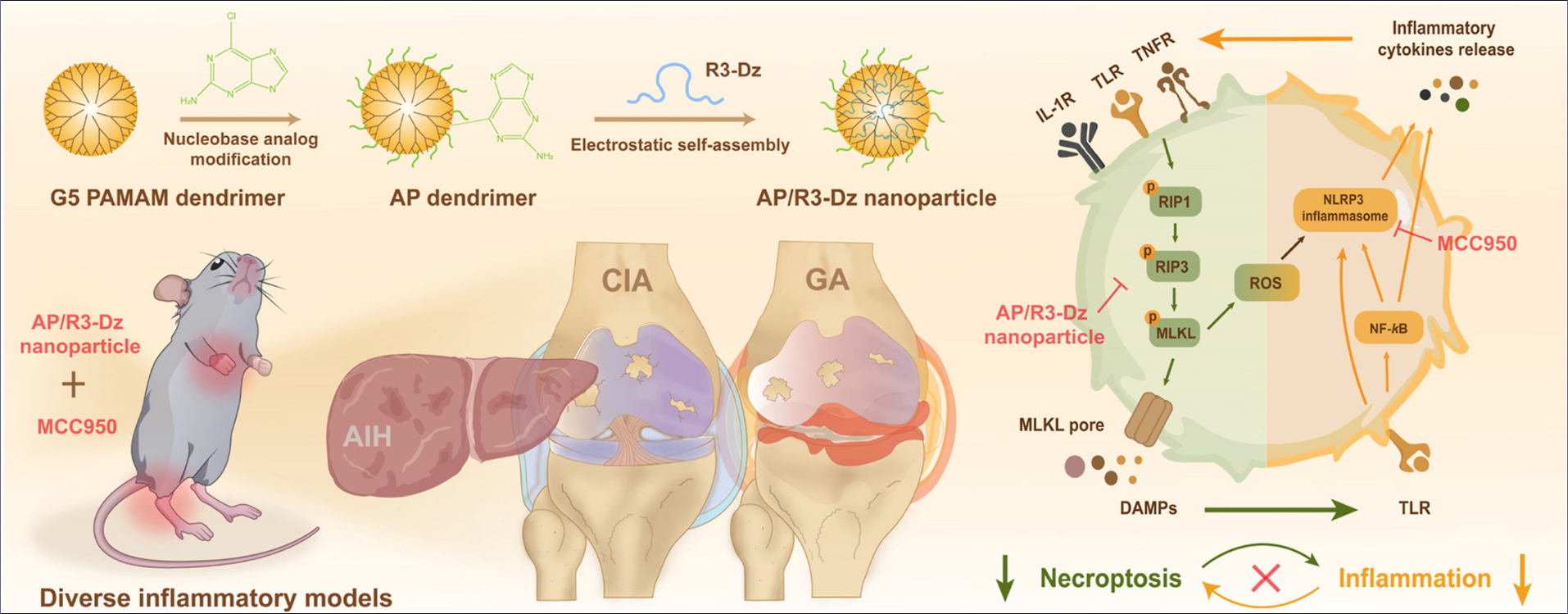
图1靶向RIP3脱氧核酶抑制NLRP3介导坏死性炎症治疗炎症性疾病的研究

研究结果:
(一)靶向RIP3脱氧核酶分子设计及催化机制解析:
首先构建程序性坏死巨噬细胞模型,探究基因沉默坏死相关激酶对细胞死亡的影响,选择RIP3作为脱氧核酶开发的分子靶标。为开发具有高效催化活性的靶向RIP3脱氧核酶,本研究创新性提出搭建脱氧核酶集成化设计平台。首先,采用生物信息学技术结合细胞学验证,从具有潜在催化活性的脱氧核酶中筛选得到R3-Dz,其能够高效抑制胞内RIP3表达水平。围绕热力学稳定性、催化结构域保守性、底物切割特异性及多重切割转换性四个方面对R3-Dz的酶学性质进行系统表征,证实R3-Dz依赖适宜互补臂及保守催化结构域,实现对底物的高效特异性切割。此外,运用分子动力学模拟从微观层面解析R3-Dz的切割机制,分别构建R3-Dz与底物(R3-Dz/S)及产物(R3-Dz/P)的核酸复合物体系。经MM/PBSA计算证实产物体系结合能下降(170.80 kcal/mol),推测R3-Dz介导底物切割反应具有自发倾向,即从模拟水平证明R3-Dz具有切割底物RNA的能力。鉴于dG14位点在RNA裂解催化过程中的关键作用,将dG14位点突变为dC14,发现R3-Dz/S核酸复合物体系内dG14-N与rA0-HO2'的原子间距离逐渐下降,而突变体不具有类似趋势,证实dG14位点在模拟过程中不断拉近与底物切割位点间的距离,介导底物进行去质子化,形成反应预催化构象,经直线进攻形式断裂磷酸二酯键。最后,向该位点引入2'-甲氧基修饰,通过稳定催化所需的拓扑构象,显著提高R3-Dz在生理环境下的切割效率,使其更适用于体内基因治疗体系。上述研究为靶向致病基因的脱氧核酶设计与应用提供理论指导,有望在调控细胞程序性坏死及下游炎症通路中发挥关键作用。
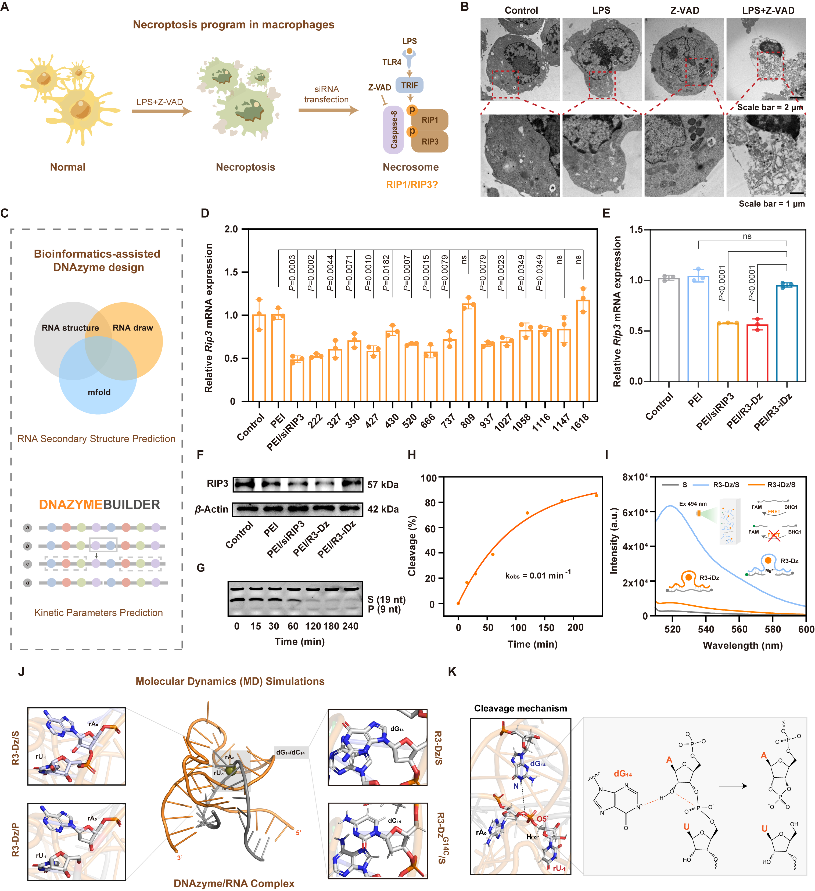
图2靶向RIP3脱氧核酶分子设计及催化机制解析
(二)AP载体介导R3-Dz递送抑制NLRP3介导坏死性炎症研究
采用碱基修饰策略对PAMAM载体进行表面修饰以制备AP载体,并通过静电相互作用介导R3-Dz高效组装形成稳定纳米复合物。碱基修饰通过氢键平衡调控与电荷理性屏蔽,赋予纳米复合物适宜的粒径、良好的生物相容性及优异的细胞转染性能。AP载体能够保护R3-Dz免受核酸酶降解,提高其在血清环境及长期储存中的稳定性。R3-Dz经AP载体递送至巨噬细胞后,通过溶酶体逃逸途径快速释放至胞质,有效规避溶酶体酸性环境介导的降解作用,从而维持有效的胞内浓度。与此同时,R3-Dz适宜的代谢速率可避免长期蓄积引起的毒副作用,在治疗效果与生物安全性间达到平衡。AP/R3-Dz纳米复合物通过降低坏死巨噬细胞内RIP3表达水平,减少坏死效应蛋白间互作及级联磷酸化,抑制细胞程序性坏死进程。采用转录组测序技术分析AP/R3-Dz纳米复合物转染后差异基因表达变化,证实AP/R3-Dz纳米复合物通过抑制细胞程序性坏死,降低HMGB1及ROS等坏死效应物释放,减轻NLRP3炎症小体的转录激活及功能组装,最终阻遏炎症反应级联放大。Ingenuity通路分析表明,AP/R3-Dz纳米复合物对多种炎症类疾病均具有良好的治疗潜力。
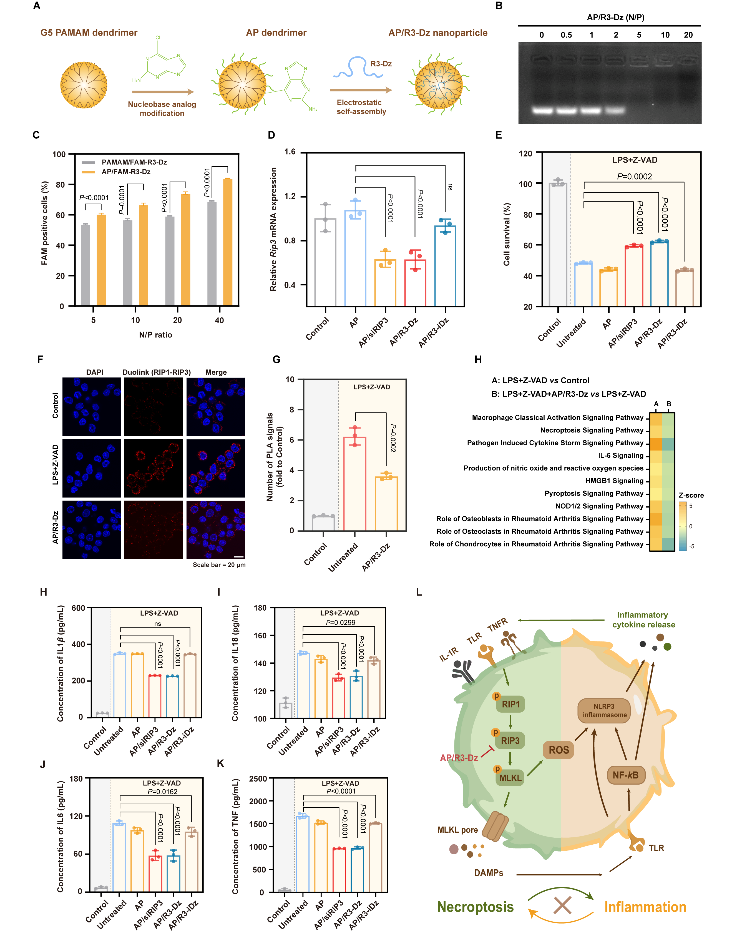
图3 AP载体介导R3-Dz递送抑制NLRP3介导坏死性炎症研究
(三)AP载体介导R3-Dz递送联合MCC950治疗多种炎症性疾病研究
采用尿酸钠局部注射构建痛风性关节炎小鼠模型,通过组织学分析揭示其发病与NLRP3介导坏死性炎症密切相关。AP载体介导R3-Dz递送有效遏制上述反馈性通路恶性循环,缓解爪部肿胀,抑制滑膜组织坏死,减轻关节炎症,在急性局部炎症模型中展现出显著的治疗潜力。利用尾静脉注射刀豆素A构建急性自身免疫性肝炎小鼠模型,联合使用NLRP3抑制剂MCC950,双向阻断NLRP3介导坏死性炎症,恢复机体肝脏代谢功能,修复肝脏坏死损伤,最终阻断急性炎症反应级联放大。最后,利用II型胶原及弗式佐剂诱导类风湿性关节炎小鼠模型。AP载体能够显著提高R3-Dz在体内的滞留时间,并通过ELVIS效应被动蓄积至发炎关节部位坏死巨噬细胞,抑制NLRP3介导的坏死性炎症。联合注射MCC950后进一步缓解小鼠滑膜组织增生,抑制软骨损伤及骨侵蚀,恢复小鼠运动能力,最终阻断慢性炎症反应进程。上述结果表明,AP/R3-Dz纳米复合物对多种炎症类疾病具有良好的治疗效果,联合MCC950能够发挥更好的抗炎功能。
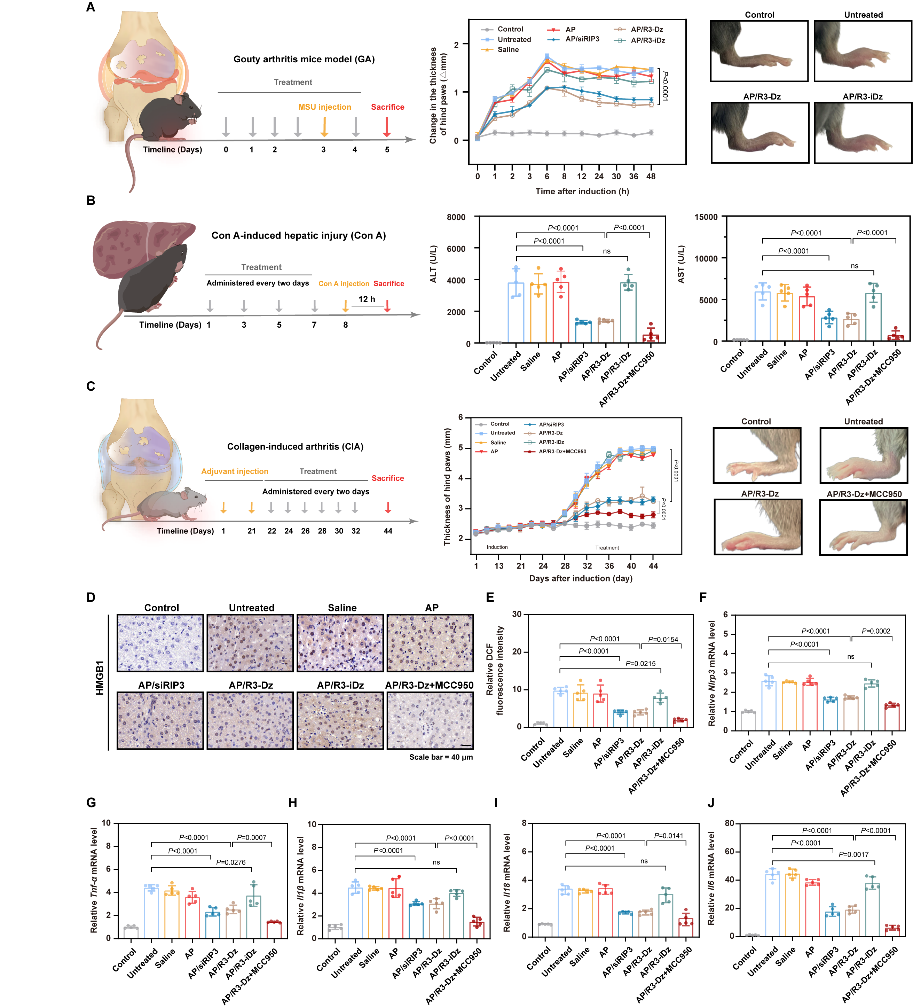
图4 AP/R3-Dz纳米复合物联合MCC950治疗多种炎症性疾病研究
总结:本研究搭建集理性筛选、性能表征、机制挖掘及酶活性改造为一体的脱氧核酶设计平台,获得具有高效体内催化活性的脱氧核酶R3-Dz。AP载体介导R3-Dz高效递送至坏死巨噬细胞,通过阻断程序性坏死的信号中枢RIP3,有效遏制NLRP3驱动的坏死性炎症风暴。联合MCC950双重阻断致病机制,能够更好实现坏死组织修复,降低全身性炎症反应。该平台的搭建不仅为靶向致病基因的核酸药物设计与开发提供理论指导,同时为炎症性疾病的精准基因治疗提供全新范式。
论文信息:
Jiaxin Jia, Hugang Zhang, Guangxu Fang, Kai Wen, Hanyu Liu, Haobo Han*, Quanshun Li*. DNAzyme targeting RIP3 suppresses NLRP3-mediated necroinflammation for the treatment of inflammatory diseases.Acta Pharm. Sin. B2025, doi:10.1016/j.apsb.2025.09.002.
 祝贺吉林大学物理学院07级校友马...10-22
祝贺吉林大学物理学院07级校友马...10-22 吉林大学召开哲学社会科学“双一...10-21
吉林大学召开哲学社会科学“双一...10-21 吉林大学召开自然科学“双一流”...10-21
吉林大学召开自然科学“双一流”...10-21 吉林省副省长王子联来校调研10-21
吉林省副省长王子联来校调研10-21 2025年国际大学生生物分子设计竞...10-21
2025年国际大学生生物分子设计竞...10-21 【吉大边疆学】吉林大学魏存成教...10-20
【吉大边疆学】吉林大学魏存成教...10-20 农业农村部科学技术司司长周云龙...10-17
农业农村部科学技术司司长周云龙...10-17 张文显教授重要成果《论建设更高...10-17
张文显教授重要成果《论建设更高...10-17


